空気清浄機、洗濯機でよく出てくるイオンという言葉。
語感が良いためか、会社名でも使われています。が、こちらはAEON。ラテン語で永遠を意味します。
今回、取り上げたいのはION。
イオンは化学で使われる用語ですが、広く使われています。
実際「マイナスイオン」が流行語として、現代用語の基礎知識にも上げられています。
が、ほとんどの人は説明し出すと、途中から話がこんがらがってしまいます。
順序立てて、それを紐解いて行きますが、今回は一番お堅い学問的な話です。
■イオンとは何か
イオンとは大まかに言うと「電荷を帯びた状態の原子、分子」のことです。
中学で周期律表を習ったと思います。
呪文を唱えながら覚えましたよね。
私は、先生から教わった習った呪文は「すい(H)へい(He)り(Li)べ(Be)、ぼ(B)く(C)の(N)(O)ふ(F)ね(Ne)、な(Na)に曲が(Mg)ある(Al)、シ(Si)ップ(P)す(S)ぐくら(Cl)あ(Ar)、キ(K)ールが(Ca)スコ(Sc)ッチ(Ti)、博(V)労(Cr)マン(Mn)、鉄(Fe)のコ(Co)ルトに(Ni)どう(Cu)煙(Zn)が(Ga)かげ(Ge)る、明日(As)千(Se)秋(Br)楽(Kr)。」です。
呪文は他にも色々あり、ネットで検索すると、ものすごい数が出てきます。
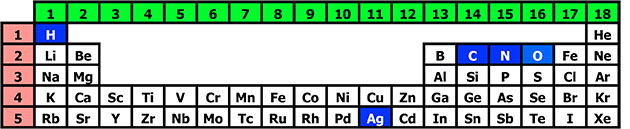
周期律表の一部。日頃お世話になっている元素が並ぶ。
青地に白地は、今回お話しの中に出てくる元素。
急に興味が沸かなくなった人もいるかも知れませんが、イオンの説明には欠かせませんのでお付き合いを。
今回は、塩(塩化ナトリウム、NaCl)を例に説明します。
「化」という漢字が出てきます。これは「イオン化」されたという意味です。
つまり「塩化ナトリウム」というのは、「イオン化された塩素とイオン化されたナトリウムが結合してできた化合物」ということです。
より具体的に説明します。
周期律表は元素の特長を表します。順番と記載される位置が重要になります。
何を示しているのかと言うと、元素(原子)の構成です。
まず、原子は「分割不可能な存在。事物を構成する最小単位。」を意味しています。
そかしそれは古代ギリシャの時代。今は、原子の構成要素まで分かっています。
原子核と電子。原子核は、陽子と中性子からできています。
陽子はプラスの電荷、電子はマイナスの電荷を持ちます。
この「陽子」「中性子」「電子」の個数と、存在する位置で、同じ「陽子」「中性子」「電子」から出来ていますが原子が持つ性質は変わります。
この性質に重きを置いた呼び方が「元素」です。
こうなると「原子」と「元素」は同意と言ってもいいのですが、その物質の性質に力点を置いて使う時は「元素」、そうでない非常に一般的な話をする場合は「原子」を使う人が多いようです。
さて、周期律表の番号は、Hを1、Heを2という具合に上から順番に付けます。
この順番を「原子番号」と言います。
原子番号は、「陽子」数を示します。
元素自体は、かなり安定な物質ですので、電気的には中性です。中性子は電気的には中性ですので、ここでは触れませんが、数は陽子と同じ数だけあります。
もうお分かりと思います。電子は陽子と同じ数だけあるのです。
次は構造です。
陽子と中性子は原子核の中にあると言われる位ですから、まとまって元素の中央に位置します。
では電子は・・・。
電子は原子核の周りを球状に廻るのですね。廻るエリアを電子殻といいます。
電子殻は複数あり、どこの位置に何個が廻るのかは決まっています。
内側から「K殻」「L殻」「M殻」・・・という名の殻があり、K殻は2つ、L殻は8つ、M殻は8つ・・・となります。
下の左図を参照してください。
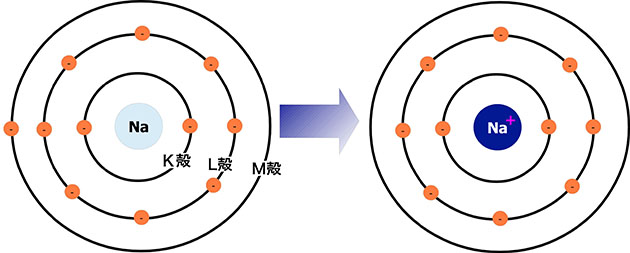
左)ナトリウム原子の模式図。M殻に電子が1つ
右)ナトリウムイオンの模式図。M殻に電子はなく、原子全体では陽子1つ分、プラスとなる。
さてナトリウムを例にして、イオンの説明をしましょう。
元素にエネルギーを与えると、元素は不安定な状態になります。その中の1つが、「イオン化」という現象です。
ナトリウムの場合は、孤立して一番不安定な M殻の電子が外に飛び出し、外れます。
これが「イオン化」です。イオン化は、最外殻の電子殻の電子が「0」もしくは「フル」になることを言うのです。
ナトリウムの場合は、電子を1つ放出。陽子1つ分、正の電荷を持ちます。
このため「ナトリウムイオン」は「陽イオン」と呼ばれます。
ちなみに塩素のイオン化は、M殻に7つある電子が8つになります。
陽子数に対し、電子が1つ多い状態です。電子1つ分、負の電荷を持ちます。
このため「塩素イオン」は「陰イオン」と呼ばれます。
イオンはギリシャ語の「ION」、「行く」が語源です。
電子が行ったり来たりするためです。
さて、塩化ナトリウムです。
これは磁石の正極と負極がくっついてしまうのと同じです。
片や電子を1つ出し不安定なナトリウムイオン。片や電子を1つ取り込んで不安定な塩素イオン。
これがより安定な状態を求めてくっつく訳です。電気的にも「0」な状態なので、安定した化合物、塩化ナトリウム。
すなわち「塩(しお)」ができる訳です。
■イオンの性質
ここ部分を聞くと多くの人は、「知ってるよ!」と言います。
では、説明する時、こんがらがるのは、何故でしょうか?
理由は、ここから先にあります。
単純に言えば、イオン化した元素は、「電荷が少なかったり多かったりするため、より安定な状態を求め、他のものと容易に結びつこうとします。」
これ以外の性質はありません。
例えば、2002年に流行した「マイナスイオン」ですが、非常に曖昧です。
もうお分かりだと思いますが「何の元素がイオンになったのか」が示されていないのが原因です。
このため「効果を説明することができない」のです。
もっと酷い言い方をしますと、役に立たないモノが販売されていた可能性もある訳です。
今回は、かなり堅い上に、長い話になってしまいました。
次回からは、「実際のイオンの使われ方」と題し、「マイナスイオン」、シャープの「プラズマクラスターイオン」、「イオン水」、「銀イオン」を紐解きたいと思います。

 RSS
RSS